
Tóm tắt nghiên cứu
Nghiên cứu được thực hiện để điều tra sự đa dạng di truyền của Circovirus type 2 (PCV2) và các mầm bệnh đồng nhiễm ở heo mắc bệnh đường hô hấp ở Việt Nam. Mẫu được thu thập trên 127 ca lâm sàng ở các tỉnh miền nam của Việt Nam từ tháng 1 năm 2018 đến tháng 1 năm 2020. Tỷ lệ nhiễm PCV2 là 78,8%, và các mầm bệnh chính đồng nhiễm với PCV2 được tìm thấy là vi rút gây hội chứng rối loạn sinh sản và hô hấp ở heo (PRRSV), suyễn (MH - Mycoplasma hyopneumoniae) và viêm đa xoang đa màng (HP - Haemophilus parasuis). Bốn mươi ba mẫu trong tổng số 100 mẫu dương tính với PCV2 từ 127 mẫu bệnh phẩm đã được chọn để giải trình tự vùng ORF2. Phân tích kiểu gien của PCV2 dựa trên ORF2 ghi nhận, có năm chủng thuộc về PCV2b (11,6%) và 38 chủng thuộc về PCV2d (88,4%), điều này cho thấy rằng kiểu gien PCV2d nhiễm chủ yếu trên heo bệnh được lấy mẫu ở các tỉnh miền nam của Việt Nam. Phân tích trình tự a-xít amin của protein capsid PCV2 cho thấy có sự khác biệt của các vị trí trong vùng nhận biết kháng thể. Nghiên cứu đã chứng minh sự phổ biến của kiểu gien PCV2d và tổng quan về các mầm bệnh đồng nhiễm liên quan đến PCV2 ở heo con mắc bệnh hô hấp ở miền Nam Việt Nam.
Phat Xuan Dinh, Minh Nam Nguyen, Hien The Nguyen, Vu Hoang Tran, Quy Dinh Tran, Kim Hoang Dang, Dai Tan Vo, Hien Thanh Le, Nam Thi Thu Nguyen, Toan Tat Nguyen, Duy Tien Do. Tạp chí Archives of Virology, 2021
Dịch: team Virbac Việt Nam
Porcine Cirovirus type 2 (PCV2) là một loại vi-rút nhỏ, không có vỏ bọc ngoài, bộ gien DNA sợi đơn thuộc họ Circoviridae. Hạt vi-rút có dạng đối xứng hình tứ diện, với đường kính khoảng 17 nm và chứa một bộ gien tròn với khoảng 1767-1768 nucleotide (nt) [10, 37]. Trong số mười một khung đọc mở (ORF) dự đoán, xếp chồng chéo và lồng vào nhau, sáu ORF (ORF1–6) đã được xác định là mã hóa các protein có liên quan đến sự nhân lên, cấu trúc, sinh bệnh, sự tồn tại của vi-rút trong tế bào và tương tác miễn dịch của vi-rút với vật chủ [13, 20, 30]. ORF2 mã hóa protein capsid của vi-rút, protein cấu trúc duy nhất của PCV2, chứa các yếu tố kháng nguyên quan trọng liên quan đến sự trung hòa vi rút [3, 29]. Do đó, gien ORF2 và protein Cap được mã hóa là các mục tiêu chính để phân tích sự đa dạng di truyền, phát sinh loài, dịch tễ học và cơ chế né tránh miễn dịch của PCV2 [34, 39].
Một số lượng đáng kể các chủng PCV2 mới đã được phân lập kể từ lần xác định đầu tiên vào năm 1991 [2]. Các chủng PCV2 có thể được phân loại thành tám kiểu gien (PCV2a- PCV2h) dựa trên phân tích gien ORF2 và trình tự gien hoàn chỉnh [9, 44, 46]. Các nghiên cứu đã ghi nhận PCV2a và PCV2b có mặt ở các trang trại heo khắp thế giới. Sự thay đổi kiểu gien của PCV2 trên toàn thế giới đã được báo cáo vào năm 2004, khi PCV2a được thay thế bởi PCV2b trở thành kiểu gien chiếm ưu thế. Gần đây, PCV2b đã được thay thế bởi kiểu gien PCV2d ở nhiều nước, trong đó có Việt Nam [12, 22, 41].
PCV2 gây ra các rối loạn lâm sàng khác nhau và được gọi là bệnh liên quan đến Circovirus ở heo (PCVADs). PCVAD bao gồm hội chứng còi cọc trên heo sau cai sữa (PMWS), bệnh hô hấp phức hợp ở heo (PRDC), hội chứng viêm da và thận ở heo (PDNS), rối loạn sinh sản, tăng sinh và hoại tử viêm phổi (PNP), run bẩm sinh loại II (CT), và viêm ruột [32]. Một trong những lý do tại sao PCV2 đóng vai trò quan trọng trong các hội chứng khác nhau được đề cập ở trên là vì PCV2 tấn công các tế bào miễn dịch, dẫn đến ức chế miễn dịch và do đó mở đường cho các vi khuẩn và vi rút cơ hội khác gây bệnh [20, 23, 24]. Do đó, nhiễm PCV2 kết hợp với các mầm bệnh khác thường được quan sát thấy ở các trang trại heo, chẳng hạn như kết hợp với vi-rút gây Hội chứng rối loạn sinh sản và hô hấp trên heo (PRRSV) (42–85,4%) [7, 24], Mycoplasma hyopneumoniae (MH) (35,5%) [26], Haemophilus parasuis (HP) (32,3%) [17], và vi rút Dịch tả heo (CSFV - Classical Swine Fever Virus) [4]. Hiện tại, PCV2 được coi là một trong những loại vi rút quan trọng nhất lây nhiễm cho heo ở một số quốc gia, bao gồm cả Việt Nam, và bệnh liên quan đến Circovirus trên heo (PCVADs) có thể gây ra thiệt hại kinh tế đáng kể cho ngành chăn nuôi heo toàn cầu.
Hiện nay, các nghiên cứu từ khắp nơi trên thế giới đã cung cấp rất nhiều kiến thức về PCV2, về cơ chế sinh bệnh, dịch tễ học và các biến thể di truyền. Tuy nhiên, thông tin về sự đa dạng di truyền của PCV2 và sự đồng nhiễm các tác nhân gây bệnh khác trên heo tại Việt Nam còn hạn chế. Trong nghiên cứu này, chúng tôi trình bày kết quả phát hiện kiểu gien PCV2 và năm mầm bệnh khác liên quan đến PRDC ở heo giai đoạn sớm sau khi cai sữa và cập nhật thông tin kiểu gien của PCV2 lưu hành trên các trang trại heo ở Việt Nam. Nghiên cứu được thực hiện với 127 mẫu của heo bệnh thu nhận từ 76 trang trại ở các tỉnh phía Nam của Việt Nam từ tháng 1 năm 2018 đến tháng 1 năm 2020. Kết quả của nghiên cứu này nhấn mạnh sự thay đổi di truyền của PCV2 trên thực địa, đóng góp vào dữ liệu dịch tễ học của PCV2 ở Việt Nam và cung cấp thông tin hữu ích cho việc phòng, chống và kiểm soát toàn diện PCVAD.
Thiết kế nghiên cứu và thu thập mẫu
Tổng cộng 127 con heo có biểu hiện lâm sàng của PRDC từ 76 trại với tỷ lệ tử vong gia tăng ở heo cai sữa đã được chọn cho nghiên cứu này. Một đến năm heo giai đoạn đầu sau cai sữa, 5-8 tuần tuổi, với các triệu chứng lâm sàng điển hình của PRDC được chọn từ mỗi trang trại. Các dấu hiệu lâm sàng của bệnh hô hấp từ trung bình đến nặng, với tổn thương phổi điển hình và bệnh lý phổi giống PRDC, bao gồm viêm phế quản phổi với các tổn thương phổi cứng ở các thùy đỉnh và viêm phổi kẽ lan tỏa kết hợp tại các thùy hoành cách mô. Phổi và các hạch bạch huyết của từng heo được thu thập để phát hiện PCV2, Circovirus type 3 (PCV3), PRRSV, CSFV, MH và HP.
Phát hiện mầm bệnh bằng PCR và RT – PCR
Cặp mồi
Các đoạn mồi được sử dụng trong phản ứng PCR và phản ứng RT-PCR trong nghiên cứu này được trình bày trong Bảng 1. Mồi cho PCV2 được thiết kế dựa trên trình tự ORF2 hoàn chỉnh (702 nt) của 66 chủng PCV2. Để phát hiện PCV3, trình tự mồi dựa theo nghiên cứu của Kedkovid et al. [14]. Đối với PRRSV, gien mã hóa NSP2 đã được sử dụng như mô tả bởi Do et al. [6]. Trình tự mồi đặc trưng cho gien E2 của CSFV theo Paton et al. [27]. Mồi để phát hiện HP được thiết kế để khuếch đại gien 16S [21]. MH được phát hiện bằng cách sử dụng mồi đặc hiệu cho gien 16S [1].

Quy trình PCR / RT – PCR
Sau khi chiết tách, DNA hoặc RNA được rửa giải với 100 μl đệm và được bảo quản ở -20 ° C cho đến khi sử dụng để xét nghiệm PCR/ RT-PCR. Tất cả PCR và xét nghiệm RT-PCR được thực hiện với tổng thể tích là 25 μl. Các thành phần của mỗi phản ứng được liệt kê trong Bảng S1 và S2. Các điều kiện cho PCR và RT-PCR được trình bày trong Bảng S3. Ba microlit của sản phẩm PCR được trộn với thuốc nhuộm DNA Gel-Red DNA stain (Merck, Đức) và sau đó được phân tích bằng điện di trong gel agarose 1% (w / v) trong dung dịch đệm Tris-borate-EDTA (TBE) 1X. Thang DNA 1 kb Plus (Invitrogien) được sử dụng làm chất đánh dấu trọng lượng phân tử để ước tính kích thước của các sản phẩm PCR.
Xác định trình tự DNA và phân tích di truyền của PCV2
Bốn mươi ba mẫu trong tổng số 100 mẫu dương tính với PCV2 từ 127 mẫu bệnh phẩm đã được chọn để giải đầy đủ trình tự ORF2 và phân tích di truyền. Sản phẩm PCR của toàn bộ ORF2, sau khi đã được làm sạch bằng bộ thương mại kit tinh sạch DNA (Wizard. Preps DNA Purification and PCR Clean-Up System, Promega, USA) được gửi đến Macrogien (Seoul, Hàn Quốc) để giải trình tự 2 chiều với cặp mồi PCV2R và PCV2F (trình bày trong Bảng 1). Trình tự ORF2 của các chủng PCV2 từ nghiên cứu này có sẵn trong cơ sở dữ liệu Ngân hàng gien theo số đăng ký MT432425-67.
Đặc điểm di truyền, so sánh trình tự theo cặp và phân tích phát sinh loài đã được thực hiện để phân biệt các chủng từ nghiên cứu này và so sánh với các chủng PCV2 từ Việt Nam trước đây và các chủng tham khảo (Bảng S4). Trình tự nucleotide đầy đủ của ORF2 từ 43 chủng PCV2 Việt Nam cùng với các trình tự tham chiếu PCV2a, PCV2b, PCV2c, PCV2d và PCV2e trên GienBank đã được so sánh bằng cách sử dụng ClustalW [36]. Sau đó, cây phát sinh loài được xây dựng theo MEGA 7 bằng cách sử dụng phương pháp so sánh đúng tối đa và theo mô hình của Hasegawa-Kishino- Yano. Giá trị Bootstrap được tính toán dựa trên 1000 lần lặp lại [35]. Trình tự a-xít amin của protein capsid của tất cả các chủng PCV2 được so sánh bằng phần mềm MegAlign và minh hoạ bằng Jalview 2.11.0.
Đồng nhiễm với PCV2 và PCV3, PRRSV, CSFV, MH, hoặc HP
Để xác định tần suất nhiễm hiện tại của PCV2 và tác nhân đồng nhiễm, 127 mẫu từ heo ở giai đoạn đầu cai sữa (5 đến 8 tuần tuổi) thu thập được từ 76 trang trại chăn nuôi heo ở các tỉnh phía Nam Việt Nam, trong khoảng thời gian từ tháng 1 năm 2018 đến tháng 1 năm 2020, và được kiểm tra bằng PCR (PCV2, PCV3, MH và HP) hoặc RT-PCR (PRRSV và CSFV). Kích thước của các sản phẩm PCR / RT-PCR tương ứng là 702 bp, 336 bp, 667 bp, 671 bp, 430 bp và 821 bp cho PCV2, PCV3, PRRSV, CSFV, MH và HP. Trong số 127 ca lâm sàng được xét nghiệm, 100 ca (78,8%) dương tính với PCV2, cho thấy PCV2 phổ biến ở Việt Nam, cũng như đã được báo cáo ở các nước khác [17, 42, 44, 46].
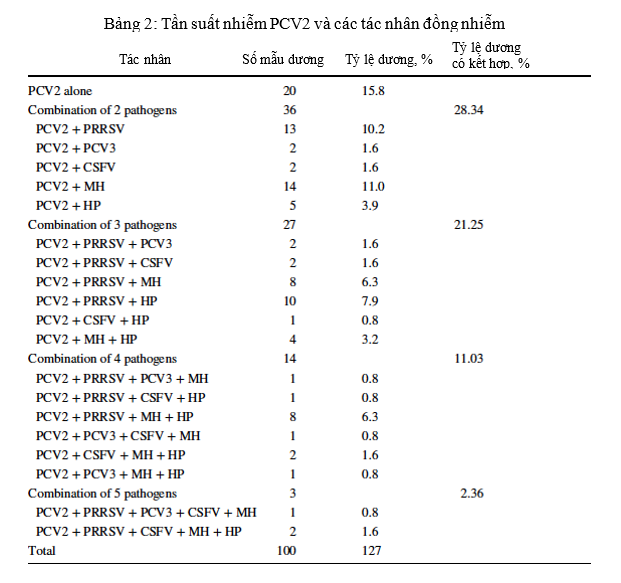
Trong 100 mẫu dương tính với PCV2, 20 mẫu (15,8% tổng số trường hợp) chỉ dương tính với PCV2, và 80 mẫu có sự đồng nhiễm với các tác nhân khác (84,2% trong tổng số các trường hợp). Tỷ lệ nhiễm trùng đồng thời với hai, ba, bốn và năm mầm bệnh tương ứng là 28,3%, 21,3%, 11,0%, và 2,4% (Hình 1). Không có mẫu nào dương tính với cả sáu mầm bệnh được điều tra. Kết quả được tóm tắt trong Bảng 2. Các kết hợp thường xuyên nhất là PCV2 / MH (11%) đối với nhiễm trùng kép, PCV2 / PRRSV / HP (7,9%) đối với nhiễm ba tác nhân và PCV2 / PRRSV / MH / HP (6,3%) đối với nhiễm bốn tác nhân. Đối với nhiễm trùng năm tác nhân, sự kết hợp PCV2 / PRRSV / CSFV / MH / HP (1,6%) nhiều hơn so với PCV2 / PRRSV / PCV3 / MH / HP (0,8%).
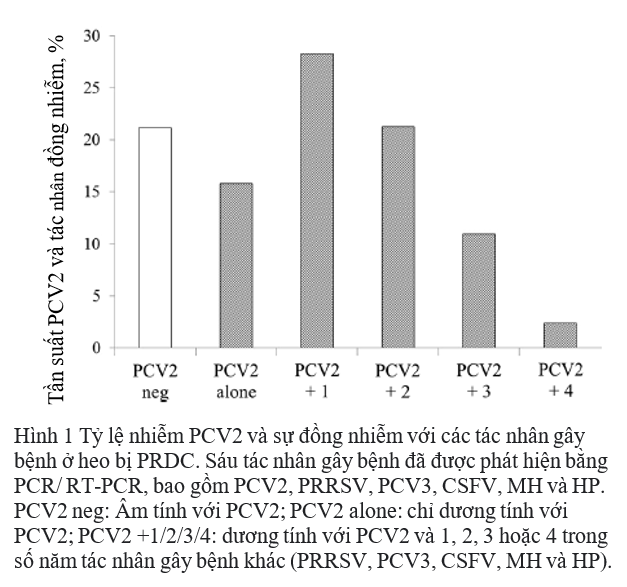
Phân tích phát sinh loài của PCV2 dựa trên ORF2
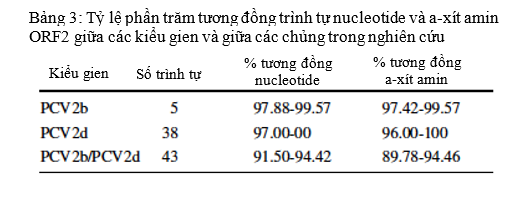
Bốn mươi ba gien ORF2 đã được giải trình tự và sử dụng để xây dựng cây phát sinh loài cùng với 48 chủng tham chiếu PCV2 từ năm 1980 đến 2018, trong đó có hai chủng từ Bỉ (PCV2d), một từ Brazil (PCV2d), 14 từ Trung Quốc (8 PCV2d, 1 PCV2e, 2 PCV2f, 2 PCV2g, 1 PCV2h), ba từ Đan Mạch (PCV2c), một từ Pháp (PCV2b), một từ Ấn Độ (PCV2f), hai từ Indonesia (PCV2e), ba từ Nhật Bản (PCV2d), một từ Ba Lan (PCV2g), một từ Thụy Điển (PCV2a), một từ Thụy Sĩ (PCV2d), một từ Đài Loan (PCV2b), một từ Thái Lan (PCV2c), sáu từ Hoa Kỳ (2 PCV2a, 2 PCV2b, 1 PDV2d) và chín từ Việt Nam (7 PCV2d, 2 PCV2h) đã được công bố trước đó. Kết quả phân tích phát sinh loài cho thấy, 43 chủng PCV2 mới tại các tỉnh phía Nam Việt nam chỉ gồm hai kiểu gien: PCV2b và PCV2d (Hình 2, Bảng 3). Năm chủng (11,6%) thuộc về kiểu gien PCV2b và 38 chủng (88,4%) thuộc về PCV2d. Các kiểu gien PCV2a, 2c, 2e, 2f, 2g và 2h không ghi nhận thấy trong số các chủng được thu thập cho nghiên cứu này.

So sánh trình tự
Để phân tích sự biến đổi của các trình tự trong mỗi kiểu gien, trình tự nucleotide của ORF2 từ 43 chủng (38 chủng PCV2d và 5 chủng PCV2b) được phân tích theo cặp và nhận dạng theo chương trình so sánh nhiều trình tự (https: //imed.med.ucm.es/Tools /sias.html). Trình tự nucleotide ORF2 của 43 chủng trong nghiên cứu tương đồng ở mức 91,50-94,42% giữa kiểu gien 2b và 2d. Sự giống nhau về trình tự cao hơn giữa các chủng trong cùng kiểu gien, với 97,88-99,57% giữa năm chủng PCV2b;và 97,00- 100% giữa 38 chủng PCV2d. Kết quả so sánh trình tự a-xít amin tương ứng cho thấy có sự tương đồng 89,78-94,46% trong 43 chủng, của cả hai kiểu gien; với 97,42-99,57% ở kiểu gien PCV2b, và 96,00-100% ở kiểu gien PCV2d (Bảng 3).
ORF2 của PCV2 mã hóa protein capsid (Cap), bao phủ hạt vi-rút và là protein bề mặt. PCV2 Cap đã được nghiên cứu kỹ lưỡng trong các nghiên cứu trước đây và cho thấy có chứa các vị trí đặc hiệu, chẳng hạn như các trình diện kháng nguyên và các vị trí liên kết với yếu tố kháng nguyên trung hòa giữ vai trò quan trọng đối với tương tác kháng thể-kháng nguyên. So sánh cho thấy, trong số 43 trình tự ORF2 của nghiên cứu với trình tự tham chiếu, có ba sự thay thế a-xít amin ở các chủng PCV2b và năm ở các chủng PCV2d. Những thay thế này bao gồm G114A, R169G, Q188H, N231K / Y và P233K ở các chủng PCV2d và K179I, N231K và P233K / T ở các chủng PCV2b. Các trình tự a-xít amin của protein Cap ở các chủng trong nghiên cứu này không có sự thêm K ở đầu cuối C, như đã được báo cáo trước đây đối với một số chủng PCV2d khác (Hình 3).
PCV2 hiện diện phổ biến trên đàn heo ở Việt Nam và là một mối đe dọa kinh tế thường xuyên [6]. Nghiên cứu đã được thực hiện để điều tra sự đồng nhiễm của PCV2 với các mầm bệnh quan trọng khác ở heo cai sữa (5 tuổi đến 8 tuần) có biểu hiện PRDC. Tổng số 127 mẫu lâm sàng được thu thập từ năm 2018 đến năm 2020 và sàng lọc PCV2 bằng PCR. Đáng chú ý, tỷ lệ nhiễm đồng thời nhiều tác nhân gây bệnh rất cao, với 84,2%. PCV2, PRRSV, MH và HP là bốn mầm bệnh quan trọng và được ghi nhận phổ biến nhất ở heo, tính theo tần suất hiện tại của PRDC trên các trang trại chăn nuôi heo ở Việt Nam. CSFV là mầm bệnh đã được kiểm soát hoặc bị loại bỏ ở nhiều quốc gia, nhưng vi-rút này vẫn hiện diện phổ biến ở Việt Nam, tham gia và làm phức tạp thêm các trường hợp PRDC. Ngoài ra, sự kết hợp của PCV2 và PRRSV đóng một vai trò chủ yếu trong những ca bệnh PRDC, điều này cũng được ghi nhận trong các nghiên cứu khác [17, 26]. Phát hiện này nhấn mạnh sự ức chế miễn dịch do hai vi-rút này gây ra khó khăn trong cuộc chiến chống lại PRDC. Hiện tại, ở Việt Nam đã có nhiều loại vắc xin phòng những mầm bệnh này, đơn giá hoặc đa giá, nhưng PRDC vẫn là mối quan tâm lớn trong quá trình chăn nuôi heo. Mặc dù việc sử dụng vắc xin rộng rãi rõ ràng sẽ thuận lợi cho việc kiểm soát dịch bệnh, nhưng áp lực được tạo ra bởi việc tiêm chủng tại các trang trại heo, cùng với chọn lọc tự nhiên lâu dài, có thể dẫn đến sự biến đổi gien và sự thất bại của vắc xin, như đối với PCV2 đã được báo cáo trước đây [25, 33, 43]. PCV2 có tỷ lệ thay đổi nucleotide cao so với các vi-rút DNA khác. Tỷ lệ đột biến ước tính cho PCV2 được xác định là là 1,2 × 10-3 mỗi năm [8]. Cùng với dữ liệu thu được gần đây trên toàn thế giới, phát hiện nổi bật của nghiên cứu là sự xuất hiện chủ yếu của kiểu gien PCV2d trong các đàn heo được lấy mẫu.
Lúc đầu, PCV2a là kiểu gien phổ biến nhất ở các quốc gia khác nhau [28], tiếp theo là kiểu gien PCV2b sau năm 2004 [16, 22], và sau đó đã chuyển sang PCV2d từ khoảng năm 2012 trở đi [40]. Ở Việt Nam, nghiên cứu hồi cứu chỉ ra rằng, PCV2 xuất hiện trước năm 2000 [40], và PCV2b chiếm ưu thế cho đến năm 2012 [41]. Sau đó, PCV2d được ghi nhận vào năm 2010 [42] và chiếm ưu thế sau năm 2014 [12]. Kết quả phân tích gien ORF2 của các chủng PCV2 trong nghiên cứu này cho thấy, hầu hết các trường hợp heo nhiễm PCV2 tại các trang trại ở Việt Nam là do kiểu gien PCV2d, tiếp theo là PCV2b. PCV2d có thể được chia thành hai loại phụ: PCV2d-1 và PCV2d-2 [42]. PCV2d-2 phổ biến hơn PCV2d-1 [41, 42]. Trong nghiên cứu này, PCV2d-2 được phát hiện là nhóm chiếm ưu thế, điều này chỉ ra rằng, những thay đổi di truyền và xu hướng tiến hóa của PCV2 ở Việt Nam cũng tương tự như ở các các quốc gia khác, chẳng hạn như Trung Quốc, Hoa Kỳ và Hàn Quốc.
Gien ORF2 của PCV2 mã hóa protein capsid (Cap), thành phần protein chính của hạt vi-rút. Protein Cap của PCV2 đóng vai trò quan trọng trong việc xâm nhập và tương tác của PCV2 với hệ thống miễn dịch của vật chủ, do vậy trình tự a-xít amin của protein Cap thay đổi nhiều hơn so với protein khác của PCV2. Các chủng hoặc kiểu gien PCV2 mới, với các protein Cap bị thay đổi, có thể dẫn đến sự khác biệt trong tương tác với vật chủ. Vì vậy, cần thiết theo dõi thường xuyên trình tự a-xít amin của protein và dự đoán những thay đổi trong cơ chế sinh bệnh, sự tiến hóa, tính kháng nguyên và khả năng sinh miễn dịch của vi rút. Các chỉ dấu của protein Cap đã được sử dụng để phân biệt các kiểu gien PCV2. Các chủng PCV2b có chỉ dấu đặc trưng là S / PNPRSV (vị trí 86–91) và A / TGIE (vị trí 190–191 / 206/210), trong khi hầu hết các chủng PCV2d có SNPLTV và TGID ở các vị trí tương ứng [5, 41, 42]. Các chủng PCV2b và PCV2d trong nghiên cứu này cũng sở hữu những chỉ dấu tương tự này, phù hợp với kết quả của các nghiên cứu gần đây [19, 44, 46].
Một số vị trí trên protein Cap của PCV2 liên quan đến sự nhận biết của kháng thể [38, 39]. Tất cả các vị trí nhận biết bởi kháng thể ở các chủng PCV2 của nghiên cứu đều ở các vùng tương tự, bao gồm G114A, R169G, Q188H, N231K / Y và P233K ở các chủng PCV2d và K179I, N231K và P233K / T ở các chủng PCV2b. Bảy a-xít amin (I53, K59, N68, L89, T90, N134 và T169) đã được xác định trên bề mặt của nucleocapsid vi-rút và có liên quan đến sự trung hòa PCV2 [18, 45]. A-xít amin 59 (A59), 77 (N77), 133 (A133), 134 (N134 đối với PCV2d và T134 cho đối với 2b), 190 (T190), 191 (G191) và 206 (I206) là các trình diện kháng nguyên giả định đối với PCV2d [15, 18, 45]. Một số vị trí này có sự đa dạng a-xít amin nhiều hơn đã được ghi nhận. Ví dụ, vị trí 53 có thể là Y, C [19], hoặc I ([45], trong nghiên cứu này); vị trí 59 có thể là K (trong nghiên cứu này và [45]) hoặc A (các chủng tham chiếu trong nghiên cứu này); và vị trí 169 có thể là R, G ([19] và trong nghiên cứu này), hoặc T [45]. Các nghiên cứu khác đã ghi nhận phản ứng âm tính với các kháng thể đặc hiệu khi protein capsid của PCV2 có một hoặc nhiều đột biến. Ví dụ, chỉ một thay đổi A59R trong protein capsid PCV2a là có thể dẫn đến mất tính đặc hiệu đối với kháng thể đơn dòng 8E4 [11], và thay đổi a-xít amin ở vị trí 131, 151, 190 và 191 đã được chứng minh là ảnh hưởng đến hoạt tính trung hòa của kháng thể đơn dòng đặc hiệu đối với các chủng PCV2a và PCV2b [31]. Phân tích trình tự a-xít amin đã chỉ ra rằng, mỗi chủng trong một kiểu gien có thể có sự thay thế khác nhau tại các vị trí giống nhau. Câu hỏi là sự đa dạng di truyền mang lại lợi ích gì cho vi-rút cần được nghiên cứu thêm.
Sự đa dạng di truyền của protein capsid của PCV2 rất hữu ích để giúp PCV2 trốn tránh sự giám sát miễn dịch. Trình tự a-xít amin xác định cấu trúc của protein, biến đổi điểm có khả năng ảnh hưởng đến cấu trúc, chức năng của protein và do đó, sự sống sót của chính vi-rút. Các đột biến trốn thoát miễn dịch và thất bại vắc-xin đã được báo cáo ở một số các quốc gia [33, 40]. Sự đa dạng quan sát được ở PCV2 trên toàn thế giới, cùng với sự thay đổi kiểu gien từ PCV2a sang PCV2b từ năm 2004, và xa hơn nữa là PCV2d từ năm 2012, chủ yếu xảy ra ở heo thương phẩm, chứng minh sự tiến hóa liên tục của vi-rút này trong các đàn đã được gây miễn dịch. Hiện tượng này cũng cho thấy rõ khả năng xuất hiện của một kiểu gien PCV2 ưu thế mới, đặc biệt là sau khi có vắc-xin mới được giới thiệu vào thị trường. Kết quả của nghiên cứu này có thể giúp xác định sự gia tăng đa dạng di truyền và đặc điểm dịch tễ học phân tử của PCV2 ở Việt Nam.
Nghiên cứu này cung cấp bằng chứng cho thấy PCV2 có liên quan đến phần lớn các trường hợp PRDC ở heo tại Việt Nam. Các tác nhân đồng nhiễm quan trọng với PCV2 bao gồm PRRSV, MH và HP, trong khi CSFV và PCV3 cũng được phát hiện nhưng ở mức độ thấp hơn. Ngoài ra, PCV2b và PCV2d cùng tồn tại ở Việt Nam, với kiểu gien PCV2d là chủ yếu. Các chủng PCV2 trong nghiên cứu này mang các biến đổi di truyền chủ yếu nằm trong vùng nhận biết bởi kháng thể của protein Cap. Những phát hiện này có thể giúp các nhà nghiên cứu đưa ra các chiến lược để lựa chọn, đánh giá, và phát triển các chủng vắc-xin hiệu quả để phòng chống PCV2 ở heo trong thực địa.
Nghiên cứu này được đồng hỗ trợ bởi Bệnh viện Thú y, Đại học Nông lâm TP.HCM và Công ty Boehringer Ingelheim Việt Nam, thông qua các cơ sở nghiên cứu và quỹ nghiên cứu. Các tác giả cũng gửi lời cảm ơn đến các cán bộ kỹ thuật của Bệnh viện Thú y, các công ty chăn nuôi heo và một số sinh viên khoa đã bỏ nhiều thời gian và công sức để tham gia vào nghiên cứu này.
Nghiên cứu được xây dựng hoặc thiết kế bởi: VHT, DTV, HTL, NTTN, TTN, DTD. Nghiên cứu đã được thực hiện bởi: MNN, PXD, HTN, VHT, QĐT, KHD, DTD. Đóng góp vào các phương pháp hoặc mô hình mới: PXD, DTV, TTN, DTD. Đã viết bài: PXD, MNN, DTD.
Các tác giả tuyên bố rằng không có xung đột lợi ích.
1. Abhijit K, Barate H-YL, Jeong H-W, Truong LQ, Joo H-G, Hahn T-W (2012). An improved multiplex PCR for diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis. Korean J Vet Res 52:39–43.
2. Allan GM, McNeilly F, Kennedy S, Daft B, Clarke EG, Ellis JA, Haines DM, Meehan BM, Adair BM (1998). Isolation of porcine circovirus-like viruses from pigs with a wasting disease in the USA and Europe. J Vet Diagn Invest 10:3–10.
3. Blanchard P, Mahe D, Cariolet R, Keranflec’h A, Baudouard MA, Cordioli P, Albina E, Jestin A (2003). Protection of swine against post-weaning multisystemic wasting syndrome (PMWS) by porcine circovirus type 2 (PCV2) proteins. Vaccine 21:4565–4575.
4. Chen N, Huang Y, Ye M, Li S, Xiao Y, Cui B, Zhu J (2019). Co-infection status of classical swine fever virus (CSFV), porcine reproductive and respiratory syndrome virus (PRRSV) and porcine circoviruses (PCV2 and PCV3) in eight regions of China from 2016 to 2018. Infect Genet Evol 68:127–135.
5. Cheung AK, Lager KM, Kohutyuk OI, Vincent AL, Henry SC, Baker RB, Rowland RR, Dunham AG (2007). Detection of two porcine circovirus type 2 genotypic groups in United States swine herds. Arch Virol 152:1035–1044.
6. Do DT, Park C, Choi K, Jeong J, Nguyen TT, Le DT, Vo KM, Chae C (2016). Nucleotide sequence analysis of Vietnamese highly pathogenic porcine reproductive and respiratory syndrome virus from 2013 to 2014 based on the NSP2 and ORF5 coding regions. Arch Virol 161:669–675.
7. Dorr PM, Baker RB, Almond GW, Wayne SR, Gebreyes WA (2007). Epidemiologic assessment of porcine circovirus type 2 coinfection with other pathogens in swine. J Am Vet Med Assoc 230:244–250.
8. Firth C, Charleston MA, Duffy S, Shapiro B, Holmes EC (2009). Insights into the evolutionary history of an emerging livestock pathogen: porcine circovirus 2. J Virol 83:12813–12821.
9. Franzo G, Segales J (2018) Porcine circovirus 2 (PCV-2) genotype update and proposal of a new genotyping methodology. PLoS ONE 13:e0208585.
10. Hamel AL, Lin LL, Nayar GP (1998). Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndrome in pigs. J Virol 72:5262–5267.
11. Huang LP, Lu YH, Wei YW, Guo LJ, Liu CM (2011). Identification of one critical amino acid that determines a conformational neutralizing epitope in the capsid protein of porcine circovirus type 2. BMC Microbiol 11:188.
12. Huynh TM, Nguyen BH, Nguyen VG, Dang HA, Mai TN, Tran TH, Ngo MH, Le VT, Vu TN, Ta TK, Vo VH, Kim HK, Park BK (2014). Phylogenetic and phylogeographic analyses of porcine circovirus type 2 among pig farms in Vietnam. Transbound Emerg Dis 61:e25-34.
13. Juhan NM, LeRoith T, Opriessnig T, Meng XJ (2010) The open reading frame 3 (ORF3) of porcine circovirus type 2 (PCV2) is dispensable for virus infection but evidence of reduced pathogenicity is limited in pigs infected by an ORF3-null PCV2 mutant. Virus Res 147:60–66.
14. Kedkovid R, Woonwong Y, Arunorat J, Sirisereewan C, Sangpratum N, Lumyai M, Kesdangsakonwut S, Teankum K, Jittimanee S, Thanawongnuwech R (2018). Porcine circovirus type 3 (PCV3) infection in grower pigs from a Thai farm suffering from porcine respiratory disease complex (PRDC). Vet Microbiol 215:71–76.
15. Khayat R, Brunn N, Speir JA, Hardham JM, Ankenbauer RG, Schneemann A, Johnson JE (2011). The 2.3-angstrom structure of porcine circovirus 2. J Virol 85:7856–7862.
16. Kim HK, Luo Y, Moon HJ, Park SJ, Keum HO, Rho S, Park BK (2009). Phylogenetic and recombination analysis of genomic sequences of PCV2 isolated in Korea. Virus Genes 39:352–358
17. Kim J, Chung HK, Jung T, Cho WS, Choi C, Chae C (2002). Postweaning multisystemic wasting syndrome of pigs in Korea: prevalence, microscopic lesions and coexisting microorganisms. J Vet Med Sci 64:57–62.
18. Lekcharoensuk P, Morozov I, Paul PS, Thangthumniyom N, Wajjawalku W, Meng XJ (2004). Epitope mapping of the major capsid protein of type 2 porcine circovirus (PCV2) by using chimeric PCV1 and PCV2. J Virol 78:8135–8145.
19. Lv N, Zhu L, Li W, Li Z, Qian Q, Zhang T, Liu L, Hong J, Zheng X, Wang Y, Zhang Y, Chai J (2020). Molecular epidemiology and genetic variation analyses of porcine circovirus type 2 isolated from Yunnan Province in China from 2016–2019. BMC Vet Res 16:96.
20. Meng XJ (2013). Porcine circovirus type 2 (PCV2): pathogenesis and interaction with the immune system. Annu Rev Anim Biosci 1:43–64.
21. Oliveira S, Galina L, Pijoan C (2001). Development of a PCR test to diagnose Haemophilus parasuis infections. J Vet Diagn Invest 13:495–501.
22. Olvera A, Sibila M, Calsamiglia M, Segales J, Domingo M (2004). Comparison of porcine circovirus type 2 load in serum quantified by a real time PCR in postweaning multisystemic wasting syndrome and porcine dermatitis and nephropathy syndrome naturally affected pigs. J Virol Methods 117:75–80.
23. Opriessnig T, Gimenez-Lirola LG, Halbur PG (2011). Polymicrobial respiratory disease in pigs. Anim Health Res Rev 12:133–148.
24. Opriessnig T, Halbur PG (2012). Concurrent infections are important for expression of porcine circovirus associated disease. Virus Res 164:20–32.
25. Opriessnig T, Xiao CT, Gerber PF, Halbur PG (2013). Emergence of a novel mutant PCV2b variant associated with clinical PCVAD in two vaccinated pig farms in the U.S. concurrently infected with PPV2. Vet Microbiol 163:177–183.
26. Pallares FJ, Halbur PG, Opriessnig T, Sorden SD, Villar D, Janke BH, Yaeger MJ, Larson DJ, Schwartz KJ, Yoon KJ, Hoffman LJ (2002). Porcine circovirus type 2 (PCV-2) coinfections in US field cases of postweaning multisystemic wasting syndrome (PMWS). J Vet Diagn Invest 14:515–519
27. Paton DJ, McGoldrick A, Bensaude E, Belak S, Mittelholzer C, Koenen F, Vanderhallen H, Greiser-Wilke I, Scheibner H, Stadejek T, Hofmann M, Thuer B (2000). Classical swine fever virus: a second ring test to evaluate RT-PCR detection methods. Vet Microbiol 77:71–81.
28. Patterson AR, Opriessnig T (2010). Epidemiology and horizontal transmission of porcine circovirus type 2 (PCV2). Anim Health Res Rev 11:217–234.
29. Pogranichnyy RM, Yoon KJ, Harms PA, Swenson SL, Zimmerman JJ, Sorden SD (2000). Characterization of immune response of young pigs to porcine circovirus type 2 infection. Viral Immunol 13:143–153.
30. Ren L, Chen X, Ouyang H (2016). Interactions of porcine circovirus 2 with its hosts. Virus Genes 52:437–444.
31. Saha D, Lefebvre DJ, Ooms K, Huang L, Delputte PL, Van Doorsselaere J, Nauwynck HJ (2012). Single amino acid mutations in the capsid switch the neutralization phenotype of porcine circovirus 2. J Gen Virol 93:1548–1555.
32. Segales J (2012). Porcine circovirus type 2 (PCV2) infections: clinical signs, pathology and laboratory diagnosis. Virus Res 164:10–19.
33. Seo HW, Han K, Park C, Chae C (2014). Clinical, virological, immunological and pathological evaluation of four porcine circovirus type 2 vaccines. Vet J 200:65–70.
34. Ssemadaali MA, Ilha M, Ramamoorthy S (2015). Genetic diversity of porcine circovirus type 2 and implications for detection and control. Res Vet Sci 103:179–186.
35. Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S (2011). MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol 28:2731–2739.
36. Thompson JD, Higgins DG, Gibson TJ (1994). CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res 22:4673–4680.
37. Tischer I, Gelderblom H, Vettermann W, Koch MA (1982). A very small porcine virus with circular single-stranded DNA. Nature 295:64–66.
38. Trible BR, Kerrigan M, Crossland N, Potter M, Faaberg K, Hesse R, Rowland RR (2011). Antibody recognition of porcine circovirus type 2 capsid protein epitopes after vaccination, infection, and disease. Clin Vaccine Immunol 18:749–757.
39. Trible BR, Rowland RR (2012). Genetic variation of porcine circovirus type 2 (PCV2) and its relevance to vaccination, pathogenesis and diagnosis. Virus Res 164:68–77.
40. Xiao CT, Halbur PG, Opriessnig T (2012). Complete genome sequence of a novel porcine circovirus type 2b variant present in cases of vaccine failures in the United States. J Virol 86:12469.
41. Xiao CT, Halbur PG, Opriessnig T (2015). Global molecular genetic analysis of porcine circovirus type 2 (PCV2) sequences confirms the presence of four main PCV2 genotypes and reveals a rapid increase of PCV2d. J Gen Virol 96:1830–1841.
42. Xiao CT, Harmon KM, Halbur PG, Opriessnig T (2016). PCV2d-2 is the predominant type of PCV2 DNA in pig samples collected in the U.S. during 2014–2016. Vet Microbiol 197:72–77.
43. Xu PL, Zhao Y, Zheng HH, Tian RB, Han HY, Chen HY, Zheng LL (2019). Analysis of genetic variation of porcine circovirus type 2 within pig populations in central China. Arch Virol 164:1445–1451.
44. Yao J, Qin Y, Zeng Y, Ouyang K, Chen Y, Huang W, Wei Z (2019). Genetic analysis of porcine circovirus type 2 (PCV2) strains between 2002 and 2016 reveals PCV2 mutant predominating in .porcine population in Guangxi, China. BMC Vet Res 15:118
45. Zhan Y, Wang N, Zhu Z, Wang Z, Wang A, Deng Z, Yang Y (2016). In silico analyses of antigenicity and surface structure variation of an emerging porcine circovirus genotype 2b mutant, prevalent in southern China from 2013 to 2015. J Gen Virol 97:922–933.
46. Zheng G, Lu Q, Wang F, Xing G, Feng H, Jin Q, Guo Z, Teng M, Hao H, Li D, Wei X, Zhang Y, Deng R, Zhang G (2020). Phylogenetic analysis of porcine circovirus type 2 (PCV2) between 2015 and 2018 in Henan Province, China. BMC Vet Res 16:6.
